|
Авторы Антрапцева Н.М., Пономарева И.Г., Ткачева Н.В., Национальный аграрный университет, Киев В настоящее время, когда развитие промышленности, транспорта, коммунального хозяйства привело к широкомасштабному загрязнению поверхностных вод неочищенными стоками, очистка воды стала одним из самых востребованных технологических процессов, а вопросы ее усовершенствования приобрели особую актуальность.
Значительную массу загрязняющих веществ в окружающую среду в виде токсичных ионов тяжелых металлов вносит металлообрабатывающая промышленность и гальваническое производство [4]. Оно относится к наиболее экологически небезопасным производствам и поэтому требует постоянного усовершенствования существующих и разработки новых эффективных и более экономичных методов очистки сточных вод от ионов тяжелых металлов. Наиболее распространенным методом очистки отработанных кислых растворов гальванических ванн является осаждение ионов тяжелых металлов в виде гидроксидов, а воды от промывки деталей после нанесения покрытия — нейтрализацией щелочными реагентами [2]. После такой очистки в воде остается в растворенном состоянии от 5 до 100 мг/дм3 ионов тяжелых металлов. По мнению авторов работы [2], осаждением с помощью растворимых фосфатов можно достичь большей степени очистки, чем щелочными реагентами. Недостатком такой технологии является сложность отделения очищаемой воды от осадков фосфатов и гидроксидов тяжелых металлов, поскольку они осаждаются в виде тонкодисперсной взвеси с размерами частиц менее 100 мкм. Выбор оптимального, экологически безопасного технологического процесса очистки промышленных сточных вод — достаточно сложная задача. Перспективным в этом плане может явиться осаждение ионов тяжелых металлов в виде нерастворимых дифосфатов, которые, согласно нашим исследованиям [6], обладают сорбирующим эффектом. Этот факт был установлен экспериментально при изучении сорбционных характеристик индивидуального дифосфата марганца и твердого раствора на его основе состава:
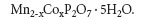
Исследования проводили в термостатированной адсорбционно-вакуумной установке с кварцевыми пружинными весами Мак-Бена при температуре 20 °С. Константы кварцевых спиралей находились в пределах 1,94– 2,9 мг/мм. Величину изменения спиралей-пружин измеряли катетометром КМ-8. Для удаления газов и паров, адсорбированных на поверхности адсорбентов, образцы предварительно откачивали при температуре 150 °С на протяжении 5 часов под вакуумом не ниже 10-3 мм рт.ст. Равновесное давление пара в адсорбционной установке определяли с помощью U-образного манометра с точностью 0,5 мм. Определение удельной поверхности по методу БЭТ включало такие стадии: оценку емкости монослоя (am) по изотерме адсорбции и расчет величины удельной поверхности по значению am с использованием молекулярной площади nm (молекулярную площадь поверхности сорбентов, занятую одной молекулой н- ексана, принимали равной 5Е [7]). Для расчета величины удельной поверхности дифосфатов использовали уравнение БЭТ [3]:
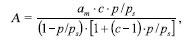
где а — величина адсорбции пара при данном относительном давлении, ммоль/г;
am — величина адсорбции пара адсорбата при мономолекулярном покрытии поверхности (емкость монослоя);
с — константа, зависящая от энергии взаимодействия адсорбат-адсорбент;
р — равновесное давление пара, мм рт. ст.;
рs — давление насыщенного пара, мм рт. ст. Эффективный радиус пор рассчитывали по формуле Кельвина [3], используя десорбционную кривую изотермы:
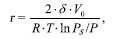
где — поверхностное натяжение, дин/см2;
V0 — молярный объем, см3/г;
R — универсальная газовая постоянная, (дин . см)/(град .моль);
Т — температура, К;
Рs — давление насыщенного пара, мм рт. ст.,
Р — равновесное давление, мм рт. ст. Для характеристики пористой структуры и адсорбционных свойств дифосфатов использовали изотермы сорбции паров метанола и н-гексана. На рис. 1 представлена изотерма адсорбции и десорбции метанола на дифосфате состава:
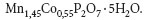 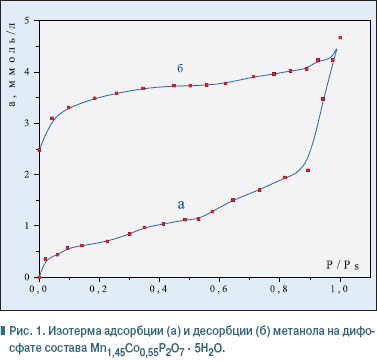
Как показали результаты исследований, метанол остается на поверхности адсорбента даже после длительного обезгаживания при низких давлениях (в пределах 1,33 . 10-2 Па). Такое его поведение, объясняется, скорее всего, образованием водородных связей между ОН-группами молекул спирта и атомами Н молекул воды дифосфата, что делает невозможным использование его для дальнейших исследований. Выбор в качестве адсорбата н-гексана вполне закономерен, поскольку его молекула не имеет дипольного момента или функциональной группы и, как следствие, не образует с поверхностью дифосфатов водородных связей или диполь-дипольного взаимодействия. Взаимодействие их за счет сил Ван-дер-Ваальса отвечает условиям применения уравнений БЭТ и Кельвина и позволяет использовать их для расчета структурно-сорбционных характеристик исследуемых дифосфатов на основе полученных изотерм адсорбции. На рис. 2 представлены изотермы адсорбции и десорбции паров н-гексана на дифосфатах общей формулы Мn2- хСохP2O7 . 5H2O с различным содержанием марганца и кобальта. Определенные на основе экспериментальных данных сорбционные характеристики дифосфатов обобщены в таблице.
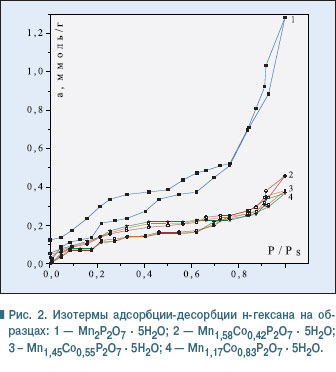
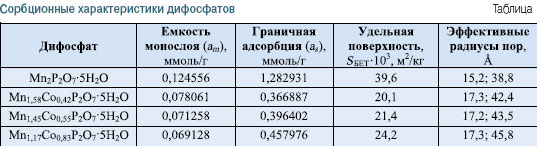
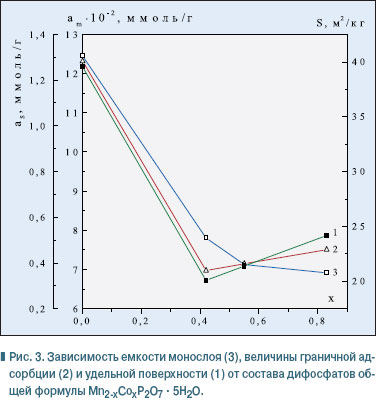
Согласно экспериментальным данным (рис. 2), изотермы имеют лэнгмюровскую форму, указывая на наличие в структуре дифосфатов переходных пор. Адсорбция паров н-гексана для дифосфатов разного состава описывается изотермами, для которых фиксируются две петли гистерезиса. Первая из них, в области низких относительных давлений P/Ps = 0,0–0,77, обусловлена капиллярной конденсацией н-гексана именно в переходных порах. Характерной для изотерм является необратимая адсорбция в области невысоких относительных давлений вплоть до P/Ps = 0. Это, скорее всего, свидетельствует о наличии микропор, которые создают пространственные сложности для десорбции н-гексана при нормальных условиях. Анализ изотерм дифосфатов разного состава показал, что десорбционная кривая изотермы на образце Мn2P2O7 . 5H2O имеет четкую волнообразную форму, свидетельствуя о полислойной адсорбции молекул н-гексана на поверхности дифосфата (рис. 2, кривая 1). По мере замещения марганца на кобальт в структуре дифосфата Мn2P2O7 форма изотерм несколько изменяется, они становятся более пологими (рис. 2, кривые 2-4). Такие изменения обусловлены тем, что появление кобальта в структуре индивидуального дифосфата Мn2P2O7 . 5H2O приводит к довольно резкому уменьшению удельной поверхности дифосфатов (см. табл.). В области составов дифосфатов Мn2-хСохP2O7 . 5H2O (0,42 < х < 0,83) удельная поверхность постепенно увеличивается. Аналогично изменяются и значения граничной адсорбции и емкости монослоя (см. таблицу). Как показали результаты расчета эффективных радиусов пор (см. табл.), дифосфаты характеризуются мезопористой структурой. Они имеют широкий набор пор с эффективными радиусами от 15 до 160 Е. Наряду с микропорами (незакрытый гистерезис) присутствуют мезопоры (15, 17 Е) и крупные поры — переходные — на грани мезопор (160 Е). Именно поры с радиусом 160 Е обеспечивают подъем адсорбционных кривых в области больших относительных давлений и появление второй петли гистерезиса в области P/Ps 0,82–1,0. Обращает на себя внимание тот факт, что с увеличением содержания кобальта в составе дифосфатов эффективный радиус пор увеличивается. На рис. 3 представлена зависимость емкости монослоя, величины граничной адсорбции и удельной поверхности от состава дифосфатов общей формулы Мn2-хСохP2O7 . 5H2O.
Сравнительный анализ сорбционных характеристик исследованных дифосфатов и таких известных сорбентов как гидроксилапатит [2,5] и фосфаты на основе титана [1] показал, что их сорбционные свойства сопоставимы. Таким образом, полученные экспериментальные данные подтверждают возможность использования дифосфатов в качестве сорбентов для очистки промышленных сточных вод. ■ Литература
1. Будовицкая Т.А. Синтез и исследование сорбционных свойств смешанных фосфатов титана, циркония и олова: Автореф. дис. канд. хим. наук. — Киев, 1992. — C. 16.
2. Высоцкая Е.В., Тарасевич Ю.И., Климова Г.М., Кузьменко Н.Л. Синтез гидроксилапатитов и применение полученных материалов для извлечения ионов тяжелых металлов из водных растворов // Химия и технология, 2002.— Т. 24, № 6. — 535-546 c.
3. Грег С., Синг К. Адсорбция, удельная поверхность, пористость. — М.: Мир,1984. — C. 306.
4. Запольский А.К. Образцов В.В. Комплексная переработка сточных вод гальванических производств.— К.:Техника, 1989. — C. 188.
5. Каназава Т. Неорганические фосфатные материалы. — К.: Наук.Думка, 1998. — C. 297.
6. Ткачова Н.В., Клюгвант А.А. Сорбційні характеристики твердих розчинів гідратованих дифосфатів мангану-кобальту (магнію) // В сб. тезисов докладов ІІІ Всеукр. конф. молодих вчених та студентів з актуальних питань хімії. — Харків. 17-20 травня 2005. — С.139.
7. McCieitan A.L., Harnsberger H.F. // J. of Colloid and interface Sci. — 1967.— V.23, № 4. — 577-599 p.
|









