|
Перспективным современным направлением в водоподготовке является обработка воды газообразным озоном О3, который в силу своих высоких окислительных свойств способен эффективно уничтожать патогенную бактериальную микрофлору и окислять многие органические соединения и металлы с их последующим разложением.
Автор: О.В. МОСИН, к.х.н., МГУПП Озонирование воды перспективно в водоподготовке питьевой воды и в водоочистке, используемой в хозяйственных нуждах, для очистки и дезинфекции сточных вод, оборотной воды бассейнов, обеззараживании воды, предназначенной для бутилирования, удаляя из воды неприятные привкусы и запахи, а также используется для дезинфекции производственных и бытовых помещений и дезодорации воздуха. В данной статье рассмотрены основные аспекты применения озона в водоподготовке. Очистка и получение пригодной для потребления питьевой воды является важным этапом водоподготовки. По традиционной схеме водоподготовка обычно включает три основных стадии: механическую фильтрацию, удаление из воды взвешенных и коллоидных веществ (осветление) и обеззараживание [1]. Удаление из воды взвесей достигается при помощи сорбционных методов и фильтров. Для осветления воды применяется химическая обработка специальными коагулянтами (сернокислый алюминий Аl(SO4)3⋅18Н2О, сернокислое железо FeSO4⋅7Н2О, хлорное железо FeCl3⋅6H2O), способными осаждать коллоидные частицы гидроксидов железа или алюминия с адсорбированными на них коллоидами загрязнений, размером до 0,07 мк [2]. Для обеззараживания воды используется обработка хлором и его производными (окись хлора (ClO2), гипохлорид натрия NaOCl), содержащими 95–97 % активного хлора [3]. Необходимость использования трех различных процессов существенно усложняет технологию обработки воды. Из‑за значительной стоимости сорбционных установок и сложности технологического процесса водоподготовки часто приходится пренебрегать улучшением вкусовых качеств воды. Кроме этого, при обработке воды коагулянтами в воду поступают дополнительные загрязнения; хлорирование, в свою очередь приводит к образованию в воде токсически опасных хлорорганических соединений. Альтернативным хлорированию способом в водоподготовке является обработка воды озоном. Озон — газ синего цвета с характерным резким запахом, образующийся при воздействии электрического разряда или ультрафиолетового излучения на воздух [4]. При низких температурах (–112 °С) озон превращается в темно-синюю жидкость, при более глубоком охлаждении образует темно-фиолетовые кристаллы (tпл = 192,7 °C, tкип = 111,9 °C, растворимость в воде при 20 °C равна 0,0394 масс. % — табл. 1). 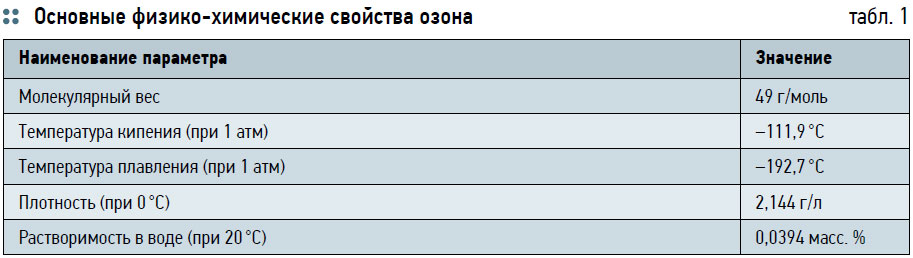
Озон применяется в очистке и доочистке питьевой воды, подготовке воды для производства пива, безалкогольной и слабоалкогольной продукции, стерилизации стеклянных и пластиковых (ПЭТ) бутылок, озонирования воды в бассейнах и аквариумах, санации стоков, дезинфекционной обработке помещений любого типа и др. По степени опасности озон относится к первому классу вредных веществ: максимальная разовая предельно допустимая концентрация (ПДК м.р.) озона в атмосферном воздухе населенных мест — 0,16 мг/м3; среднесуточная ПДК (ПДК с.с.) озона в атмосферном воздухе населенных мест — 0,03 мг/м3; ПДК озона в воздухе рабочей зоны составляет 0,1 мг/м3. По химическому строению озон представляет собой молекулу, состоящую из трех атомов кислорода с длиной связи 1,278 А° и валентным углом 116,8° (рис. 1). Молекула озона полярна, ее дипольный момент 0,534D. 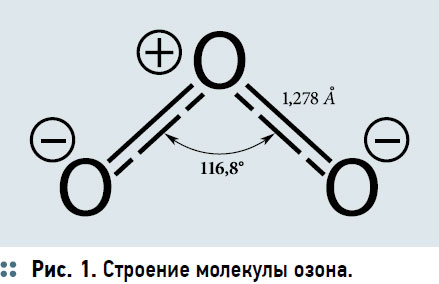
Озон неустойчив и при нормальных условиях (20 °C, 1 атм) самопроизвольно превращается в кислород O2 с генерированием атомарного кислорода и выделением тепла. Период полураспада озона в воздухе составляет 30–40 мин. Повышение температуры и понижение давления увеличивают скорость перехода озона О3 в O2. При больших концентрациях О3 процесс может носить взрывной характер. Контакт озона даже с малыми количествами органических веществ, некоторыми металлами или их оксидами ускоряет превращение О3 в O2. Озон — сильный окислитель и со многими непредельными органическими соединениями образует озониды — промежуточные продукты присоединения озона по двойной связи [5]. Первичным продуктом взаимодействия озона является малозоид (1, 2, 3-триоксолан), который неустойчив и распадается на карбонилоксисид [> C = O–O]* и карбонильные соединения — альдегиды или кетоны. Реакция озонирования чрезвычайно экзотермична, избыток тепла уходит на электронно-колебательное возбуждение образующихся продуктов реакции и частично рассеиваются молекулами растворителя. Промежуточные продукты, образующиеся в этой реакции, вновь реагируют в другой последовательности, образуя озониды. В присутствии веществ, способных вступать в реакцию с карбонилоксидом (спирты, кислоты), вместо озонидов образуются различные перекисные соединения. Озон активно вступает в реакцию с ароматическими органическими соединениями, при этом реакция идет как с разрушением ароматического ядра, так и без его разрушения [6]. При взаимодействии озона с фенолами происходит образование соединений с нарушенным ароматическим ядром (типа хиноина), а также малотоксичных производных непредельных альдегидов и кислот. В реакциях с насыщенными углеводородами, протекающих как в водных растворах, озон вначале распадается с образованием атомарного кислорода, который инициирует цепное окисление [7]. При этом выход продуктов окисления соответствует уровням расхода озона. Озон также способен взаимодействовать с щелочными металлами — натрием Na, калием K, рубидием Rb, цезием Cs, посредством формирования промежуточного неустойчивого комплекса катиона металла с озоном [М+–О–Н+–O3 –]*, в результате последующего водного гидролиза которого образуется смесь озонида МО3 и водного гидроксида щелочного металла (MOH) [8]. Озон — сильный дезинфектант, оказывающий выраженное бактерицидное воздействие на многие патогенные микроорганизмы, бактерии и вирусы. При оценке эффективности озона используется С⋅Т‑критерий, т.е. произведение концентрации реагента на время его действия. По своему дезинфицирующему действию озон превосходит хлор, хлорамин и двуокись хлора (табл. 2). 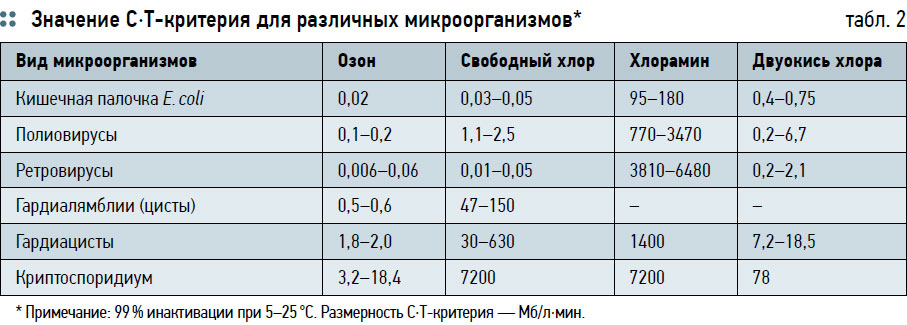
Из‑за высокой окислительной способности озон действует как сильный окислитель на клеточную стенку мембран микроорганизмов с последующим проникновением внутрь клетки и окислением жизненно важных биологически активных соединений (белки, ферменты, ДНК, РНК) [9]. Благодаря своим окислительным свойствам озон уничтожает бактерии в три-пять раз эффективнее УФ‑излучения и в 500–1000 раз сильнее хлора. Озон более эффективен, чем хлор, при уничтожении кишечной палочки Еcherihia coli, которая в воде уничтожается озоном в 1000 раз быстрее, чем хлором [10]. Время, необходимое для уничтожения Endamoeba hystolica при остаточной концентрации озона в воде 0,3 мг/л, составляет 2–7,5 мин., а для хлора (ост. концентрация 0,5–1 мг/л) — 15–20 мин. Вирус полиомиелита уничтожается озоном за две минуты при концентрации 0,45 мг/л, тогда как при обработки воды хлором в концентрации 1 мг/л для этого требуется три часа [11]. Все эти вышеперечисленные факторы способствуют применению озона в водоподготовке, имеющей ряд неоспоримых преимуществ по сравнению с другими существующими технологиями, в т.ч. хлорированием воды (табл. 3). 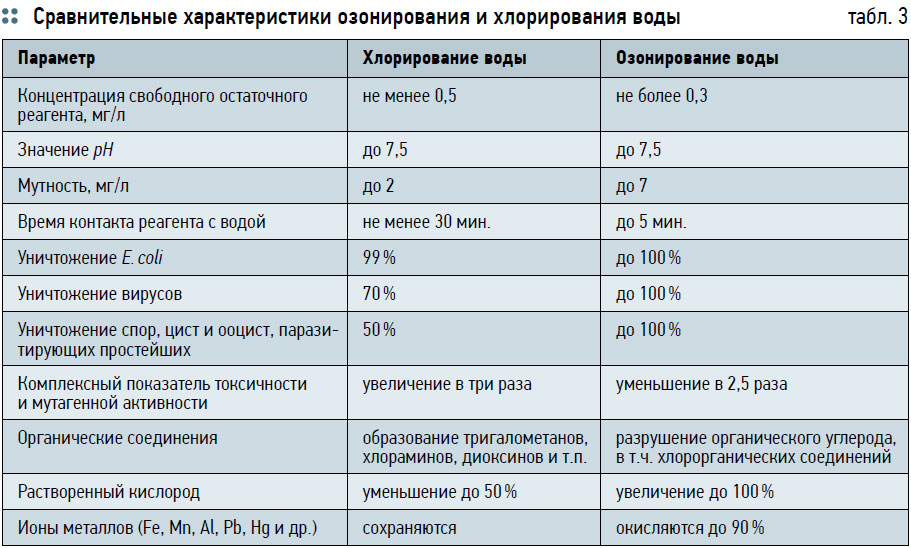
Важным преимуществом является неспособность озона в отличие от хлора, к реакциям замещения с органическими соединениями, приводящими к образованию побочных токсичных хлорорганических соединений — тригалометанов, главным представителем которых является хлороформ (СHCl3) [12]. Показано, что в процессе хлорирования воды может образовываться до 50‑ти различных галогенсодержащих соединений, включая бромоформ (СHBr3), дибромхлорметан (CHBr2Cl), бромдихлорметан (CHBrCl2), и хлороформ (СHCl3) [13]. Озонирование в водоподготовке не приводит к образованию тригалометанов и за счет высокой окислительной способности озона позволяет одновременно достичь осветления воды и осаждения примесей, а также устранить привкусы и запахи при обеззараживании. По многим характеристикам, включая комплексный показатель токсичности и мутагенной активности, озон превосходит хлор и его производные (табл. 2). При растворении в воде озон разлагается на О2 с генерированием реакционно-способного атомарного кислорода, способного быстро окислять загрязнения органической и неорганической природы, переводя их из растворенного состояния во взвеси, задерживаемые сорбционным фильтром [14]. По современной технологии производство озона осуществляется на месте потребления на специальных установках — озоногенераторах, генерирующих озон при высокочастотном коронном разряде в потоке осушенного воздуха. Расход энергии при этом процессе составляет 5–15 кВт/(кг О3⋅ч), концентрация озона в воздушно-озонной смеси выходит примерно 50–250 г/м3. Полученный таким способом озон, затем подается в систему водоподготовки за счет методов барботажа и инжекции. В крупных промышленных установках наиболее часто используется барботаж озоно-воздушной смеси через очищаемую воду. При этом, важным технологическим этапом является обеспечение одинакового времени контакта газообразного озона с водой, а также равномерное введение его по всему объему обрабатываемой воды. В установках относительно небольшой производительности по озону наиболее распространен и достаточно эффективен метод инжекции. Очищаемая вода проходя через инжектор, создает в нем разрежение, при котором в воду поступает необходимое количество газообразного озона. Интенсивное перемешивание в инжекторе диспергирует озон на мельчайшие пузырьки с большой поверхностью контакта, тем самым повышая скорость растворения озона в воде. Совместить эффективное растворение озона и время его контактирования с водой позволяют пульсационные колонны со специальными распределительными тарелками. Озоно-воздушная смесь поступает в нижнюю часть колонны; возвратно-поступательное движение воды, создаваемое специальным пульсатором, и распределительные тарелки обеспечивают ее диспергирование до пузырьков заданных оптимальных размеров, которые поднимаются противотоком к двигающемуся вниз потоку воды. В результате этого процесса достигается высокая степень дисперегирования озона при большой удельной производительности аппарата. После растворения озона в воде необходимо обеспечить нужное время его контакта с водой для осуществления химических реакций окисления и удаления из воды избыточного количества непрореагировавшего озона и продуктов распада. Для этого применяется контактнофильтровальный аппарат, из которого вода направляется на фильтр на основе активированного угля для каталитического окисления продуктов взаимодействия озона с органическими соединениями с последующей их задержкой фильтром и деструкцией озона (рис. 2). 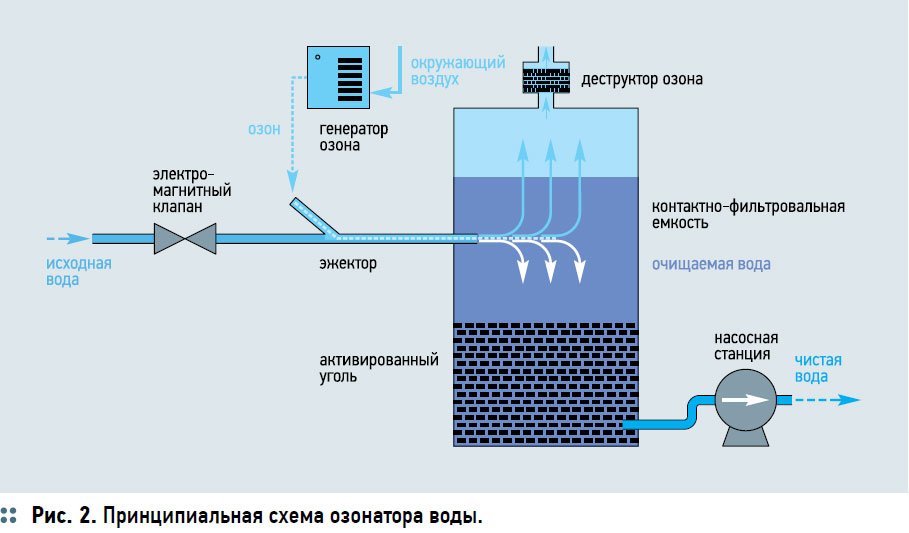
Применение современных передовых технологий производства озона позволяют создавать малогабаритные, надежные, высокопроизводительные и легкие в наладке и обслуживании отечественные системы озонирования воды, снабженные датчиками электронного контроля и системами регулирования. ЗаключениеПреимущества озона по сравнению с технологией хлорирования заключаются в следующих факторах: озон экологически безопасен и не образует токсичных побочных продуктов распада; остаточный озон быстро превращается в кислород; озон вырабатывается на месте, не требуя хранения и перевозки; озон уничтожает все известные микроорганизмы: вирусы, бактерии, грибы, споры, цисты, простейших и т.д. в 300–1000 раз быстрее, чем др. дезинфектанты; не существует и не может возникнуть устойчивых к озону форм микробов; обработка воды озоном занимает несколько минут; озонирование удаляет из воды неприятные запахи и привкусы; одновременно с обеззараживанием происходит осветление воды. К недостаткам озона следует отнести сложность его производства на месте использования, необходимость значительных энергозатрат, связанных с его получением, а также недостаточно высокую устойчивость озона в воде, разлагающегося в ней в течении 30–40 минут. 1. Фрог Б.Н., Левченко А.П. Водоподготовка. — М.: МГУ, 1996.
2. Бахир В.М. Современные технические электрохимические системы для обеззараживания, очистки и активирования воды. — М.: ВНИИИМТ, 1999.
3. Милюкин М.В. // Химия и технология воды, ¹ 1/1998, Т. 20.
4. Hozvath M.H., Bilitrki E. Ozone Ed. Akademie. Kiado. Budapest, 1987.
5. Criegee R. Mechanism of Ozonolysis // Angewandte Chemie, ¹ 14/1975.
6. Розумовский С.Д., Заиков Г.З. Озон и его реакции с органическими соединениями. — М., 1974.
7. Лукин В.В., Попович М.П., Ткаченко С.Н. Физическая химия озона. — M.: МГУ, 1998.
8. Некрасов Б.В. Основы общей химии. Т. 1. — М.: Химия, 1973.
9. American Water Works Association Journal. Survey of Water Utility Disinfection Practices. Water Quality Disinfection Committee Report, Sept. 1992.
10. Geo G., White C. Handbook of chlorination and alternative disinfectants. Fourth Edition. A Wiley Interscience Publication, 1976.
11. Naumman E. Das gas und Wassertach. NY, 1952.
12. Tardif R.G. Balancing Chemical and Microbial Risks: Weight-of-Evidence for Cancer Risks of Chlorine Disinfection of Drinking Water. Report prepared for EPA Advisory Committee to Negotiate the Disinfection By‑products Rule, 1993.
13. Dojbido J. Образование промежуточных веществ в процессе озонирования и хлорирования // Water Resources, ¹ 4 (33)/1999.
14. Драгинский В.Л., Алексеева Л.П., Самойлович В.Г. Озонирование в процессах очистки воды. М.: «Дели принт», 2007. |









