Вода, как самый распространенный в биосфере планеты Земля минерал, как среда, в которой зародилась жизнь на Земле, как самое загадочное по своим физико-химическим свойствам вещество, было, остается и будет объектом пристального внимания исследователей
В.А. ПРИСЯЖНЮК, к.х.н.
2. Электрохимические методы анализа и контроляЗа более чем 300 лет существования аналитической химии в ее арсенале накопилось огромное количество методов и средств обнаружения, определения и контроля состава веществ, с которыми приходится встречаться человеку в быту и производственной деятельности. В
табл. 2 перечислена только незначительная часть того, с чем имеет дело практикующий химик-аналитик.

Особый интерес для промышленной практики представляют электрохимические методы анализа, которые позволяют автоматизировать мониторинг окружающей среды обитания человека, контроль за соблюдением норм технологического режима на производстве, контроль качества продукции.
Естественно, что в этой главе мы сосредоточимся только на методах, применяемых в технологии производства воды.
Электрохимические методы анализа основаны на использовании электрохимических процессов, протекающих в электролитической ячейке (гальваническом элементе, цепи). Электрохимическая система состоит из: электродов — измерительного, вспомогательного и электрода сравнения; электролитов — анализируемого и стандартного раствора; электрод-ного мостика, замыкающего электрическую цепь в системе. Физической сущностью данных методов анализа является изменение электрических параметров системы в зависимости от концентрации, электрохимических реакций на границах раздела фаз, величины и знака адсорбционного слоя. Аналитическим сигналом при электрохимических измерениях могут служить напряжение, ток, сопротивление или проводимость. Электрохимические методы анализа позволяют определять концентрацию вещества в очень широком диапазоне — от 1 до 10–9 моль/л с достаточной точностью и воспроизводимостью, легко автоматизируются, что позволяет использовать их для автоматизации технологических процессов.
2.1. Измерение электропроводности — кондуктометрияПеренос электричества в электролитах осуществляется ионами. В электрическом поле анионы (отрицательно заряженные ионы) движутся к положительно заряженному электроду — аноду, катионы (положительно заряженные ионы) движутся к отрицательно заряженному электроду — катоду. Катионы и анионы электрический ток переносят в равной степени, совместно, но скорость движения ионов может быть разной. Она зависит от напряженности электрического поля, радиуса иона, заряда иона и вязкости раствора. В электрохимии принято измерять электропроводность раствора, а не его электрическое сопротивление. Электропроводность обратна по величине элек-трическому сопротивлению R = 1R. Единица измерения электропроводности в СИ (международной системе единиц измерения) — Сименс.
Размерность электропроводности ом–1 см–1, или См/см.
В разбавленном растворе (до 0,001 моль/л), каким является вода из обычных источников водопользования, можно пренебречь характеристикой отдельных ионов, находящихся в растворе, и с незначительной натяжкой принять, что электропроводность пропорциональна концентрации растворенных солей.
Аппроксимация (приблизительная запись) опубликованных в литературе данных приводит к экспериментальному уравнению:
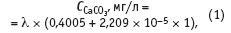
где — электропроводность в микросименсах; ССаСО3 — концентрация солей в мг/л в пересчете на карбонат кальция. Коэффициент множественной корреляции уравнения (1) R2 = 0,999996, среднеквадратичное отклонение при расчете концентрации карбоната кальция s = ±1 мг/л. Уравнение (1) справедливо в диапазоне концентраций карбоната кальция в воде от 0,4 до 425 мг/л. В центре указанного диапазона концентраций оно дает относительную ошибку 100 1210 = ±0,5 %. При пересчете уравнения (1) в мг-эквиваленты СаСО3 оно принимает вид:
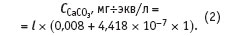
В этом случае среднеквадратичное отклонение при расчете концентрации карбоната кальция составит s = ±0,02 мг-экв/л. Уравнение (2) применимо для расчета концентраций карбоната кальция в воде в диапазоне от 0,008 до 8,5 мг-экв/л.
Прибор для измерения электропроводности раствора называется кондуктометром. Выпускает лабораторные и портативные кондуктометры, например, фирма «Аналит-сервис» (Москва), предлагая портативный кондуктометр «АНИОН-7020» стоимостью около 17 тыс. руб. Прибор градуирован в единицах концентрации хлорида натрия, предназначен для измерения солесодержания в воде.
Санкт-Петербургская фирма «ПК Кварц» выпускает промышленный кондуктометр-концентратомер «Кварц-2» (ТУ 4215-007-27428832–01), современный многофункциональный промышленный прибор для непрерывного измерения удельной электропроводности.
2.2. Измерение концентрации ионов — потенциометрияПотенциометрический метод основан на измерении электродвижущей силы (ЭДС) гальванических элементов. Применяется потенциометрия для определения концентрации растворенного вещества, а также измерения различных физико-химических величин.
При соприкосновении двух проводников тока, твердых или жидких, на границе контакта возникает скачок потенциала. Скачки потенциала, из которых складывается ЭДС, можно разделить на три группы:
- скачки контактных потенциалов, возникающие на границе соприкосновения металл–металл;
- скачки электродных потенциалов, возникающие на границе контакта металл–электролит;
- скачки диффузионных потенциалов, возникающие на границе электролит–электролит.
Электродный потенциал возникает при погруженииметалла (обычно это металлическая проволочка) в раствор электролита. Ионы, находящиеся на поверхности кристаллической решетки металла, взаимодействуют с сильно полярными молекулами воды, гидратируются. Связь их с ионами кристаллической решетки металла ослабляется, и они переходят в раствор, образуя положительно заряженный потенциалообразующий слой. Одновременно из раствора на поверхность металла в потенциалобразующий слой переходят отрицательно заряженные ионы растворенного вещества.
Если скорость перехода ионов металла в раствор выше, чем скорость перехода отрицательно заряженных ионов электролита на поверхность металла, то потенциалобразующий слой заряжается отрицательно. Если скорость перехода ионов металла в раствор ниже, чем скорость перехода положительно заряженных ионов электролита на поверхность металла, то потенциалобразующий слой заряжается положительно.
Как всегда бывает в кинетических процессах, скорость перехода ионов из раствора будет зависеть от концентрации и температуры. Чем выше концентрация растворенного вещества, тем выше знак заряда электрода.
Диффузионный потенциал возникает на границе контакта двух электролитов или двух растворов, содержащих один и тот же ион, но в разных концентрациях. При контакте ионы начинают переходить из одного раствора в другой. Чем выше концентрация раствора, тем выше скорость перехода из него ионов в более разбавленный раствор. Подвижность — скорость движения — катионов и анионов различна, и это приводит к перераспределению заряда между контактирующими растворами. Один из растворов у границы контакта обогащается положительно заряженными ионами (катионами), а другой — анионами. Так на границе образуется двойной электрический слой с определенным скачком потенциала.
Обычно гальванический элемент состоит из двух электродов, которые погружены в один и тот же раствор или в различные по составу растворы, имеющие между собой жидкостной контакт. Электрод, с помощью которого предполагают измерять концентрацию какого-либо иона в растворе, называют индикаторным. Второй электрод, погруженный в раствор с постоянной концентрацией, называют электродом сравнения.
Электроды, на поверхности которых протекают реакции с участием электронов, называют электронобменными. Мембранными, ионобменными или ионселективными электродами называют такие, на поверхности которых протекают ионобменные реакции.
2.2.1. Ионселективные электродыИонобменные электроды состоят из мембраны, проницаемой, как правило, для одного типа ионов, и стандартного (известной концентрации) раствора, содержащего те же ионы. Образующаяся между индикаторным и электродом сравнения разность потенциалов определяется разностью концентраций ионов в стандартном растворе и в том, в котором предстоит определить концентрацию этого же иона. На сегодняшний день разработано большое число электродов, селективных (избирательных) к определенному виду ионов. Например, к Н+, Ca2+, Mg2+, Na+, K+, NH4 +, Cl–, NO3 – и т.д. Особенно широко известна так называемая рН-метрия («пэ-аш»-метрия), позволяющая определить концентрацию в растворе иона водорода (протона). Лабораторные и промышленные рН-метры (ионометры) выпускают фирмы «Аналит-сервис» и «ПК Кварц», упомянутые в главе 2.1 о кондуктометрии.
О возможностях, которые в химии воды открывает рН-метрия, уже рассказывалось в статье [2]. В растворах с карбонатной жесткостью, но создаваемой солями угольной кислоты и сильной щелочи (Na+, K+), рН-метрия позволяет определить соотношение карбонат, гидрокарбонат-иона и недиссоциированной угольной кислоты. В диапазоне значений рН от 4,46 до 8,46 (∈4,46; 8,4) в растворе присутствует свободная углекислота и гидрокарбонат-ион, но практически отсутствует карбонатион:
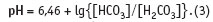
Граница этой области, как упоминалось в главе 1.3, фиксируется индикатором метиловым оранжевым, область изменения окраски которого лежит при рН ∈3,1; 4,4.
В диапазоне значений рН ∈8,25; 12,25в растворе присутствует карбонат-ион и гидрокарбонат-ион, но практически отсутствует свободная углекислота:
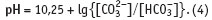
Нижняя граница этой области фиксируется индикатором фенолфталеин, область изменения окраски которого лежит при рН ∈8,2; 10,0.
Уравнения (3) и (4) позволяют по данным о рН карбонатно-гидрокарбонатного раствора, например соды, рассчитать соотношение карбоната, гидрокарбоната или гидрокарбоната и свободной угольной кислоты:
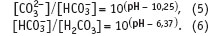
Однако если в воде кроме карбонатной жесткости присутствует и кальциево-магниевая жесткость, ситуация совершенно меняется. В этом случае рН раствора отражает равновесную концентрацию (на это указывают квадратные скобки) всех присутствующих в растворе слабодиссоциирующих соединений:
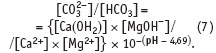
Изменение концентрации как кальция, так и магния будет влиять на соотношение концентраций карбонатиона и угольной кислоты сложным образом.
Совместно используя ионселективные электроды и кондуктометрию, можно автоматизировать контроль свойств и состава воды, поступающей на водоподготовку, воды в процессе водоподготовки и воды, передаваемой потребителю.
Хотелось бы поделиться некоторыми наблюдениями, накопленными при эксплуатации промышленных проточных рН-метров. Очень часто показания проточного промышленного рН-метра вдруг скачком меняются. Оказывается, что это связано с изменением расхода жидкости через измерительную ячейку. Как это ни парадоксально, но складывается впечатление, что изменение расхода воды меняет толщину диффузионного слоя противоионов, компенсирующих заряд потенциалобразующих ионов на поверхности ионселективного электрода.
Снизить влияние этого фактора на показания приборов, ведущих измерение в потоке, можно только стабилизацией скорости обтекания электрода жидкостью. Убрать влияние скорости обтекания жидкостью электрода невозможно, но воздействие этого фактора можно перевести из разряда «случайной ошибки измерения» в разряд «постоянной ошибки измерения» или «смещенной оценки».
Величину смещения легко учесть, вводя постоянную поправку. Поскольку скорость потока равна соотношению расхода жидкости и проходного сечения измерительной ячейки, снизить влияние скорости можно, увеличивая проходное сечение:
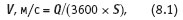
где Q — расход жидкости, м3/ч; S — проходное сечение ячейки, м2.
Стабилизировать в некоторой степени скорость воды можно калиброванным отверстием, учитывая зависимость:
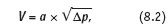
где а — коэффициент пропорциональности; p — потеря напора на гидравлическом сопротивлении.
3. Методы прогнозирования свойств водыАвтор уже неоднократно подчеркивал в своих статьях [1, 2], что вода из разных источников водоснабжения очень неоднородна по составу и, как следствие, по своим потребительским и эксплуатационным свойствам. Естественно, что попытки прогнозировать свойства воды по данным о ее составе предпринимались уже давно. Наиболее известным и хорошо разработанным методом оценки коррозионно-накипных свойств воды является метод Ланжелье [3]. Этот метод качественной оценки свойств воды разработан химиком Ланжелье еще в 30-е годы ХХ столетия.
По данным химического анализа вычисляется индекс Ланжелье, величина которого позволяет оценить способность воды вызывать коррозию стали или склонность к накипеобразованию. За последние 70 лет неоднократно делались попытки улучшить, усовершенствовать, упростить вычисление индекса Ланжелье. Но, тем не менее, в основе множества разработанных на сегодняшний день методов оценки свойств воды лежит всетаки индекс Ланжелье.
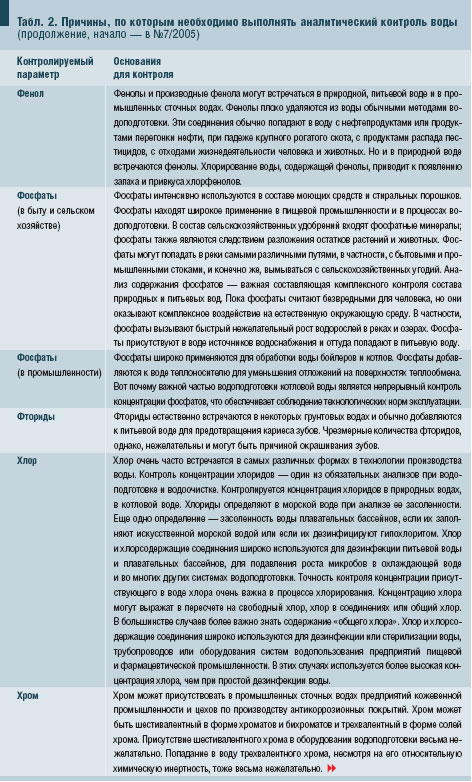
3.1. Индекс Ланжелье (ИЛ)Вода — наиболее распространенный на планете Земля жидкий минерал. Она же — универсальный растворитель. Как следствие, подавляющее большинство жидкостей, с которыми человеку приходится сталкиваться в быту, в производственной деятельности — это водные растворы. Достаточно заглянуть в табл. 2, чтобы ознакомиться только с частью того, что может быть растворено в природной воде, что растворяет человек в воде, чтобы придать ей определенные потребительские свойства.
3.1.1. Теоретическое обоснование метода ЛанжельеУченые, исследующие свойства растворов, давно заметили, что свойства растворенного вещества, так же как и свойства растворителя, зависят от концентрации. Под концентрацией (обозначается обычно латинской букой С) количество вещества, растворенное в единице объема (реже массы) растворителя.
Попытку учесть изменение свойств раствора в зависимости от его концентрации предпринял в 1907 г. физико-химик Г. Льюис. Он ввел понятие «активности» вещества в растворе — реально наблюдаемой концентрации. Активность обычно обозначают буквой a. Соотношение между активностью и концентрацией определяется коэффициентом активности:

В очень разбавленных растворах, т.е. в растворах с очень малым количеством растворенного вещества, активность равна концентрации. Коэффициент активности f при этом стремится к 1.
Ионселективный электрод измеряет активность вещества, т.е. результат его реального присутствия. Концентрацию — истинную массу — растворенного вещества позволяет установить химический анализ.
Как было показано в разделе 2.2.1, водородный показатель воды как раствора (рН), измеряемый соответствующим электродом, отражает результат равновесных активностей всех компонентов этого раствора. Химический анализ позволяет определить концентрации компонентов раствора и по этим данным вычислить рН.
Как раз разность между рН, рассчитанным по данным химического анализа, и рН измеренным (активностью компонентов раствора) Ланжелье предложил рассматривать как индекс (цифровой показатель) свойств воды.
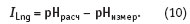
Если ILng 0, т.е. отрицательная величина, то такая вода вызывает коррозию стали. Если ILng 0, такая вода нейтральна, стабильна. Она не вызывает ни коррозии, ни накипеобразования. Поскольку индекс Ланжелье — характеристика скорее качественная, чем количественная, не следует слишком буквально воспринимать равенство нулю.
Кроме того, никто не отменял наличия ошибки измерения и аппроксимации (вычисления по принятым уравнениям). Значения индекса Ланжелье в пределах –0,3; +0,3надо воспринимать как «ноль». Если ILng 0, т.е. положительная величина, то такая вода склонна вызывать накипеобразование на поверхности трубопроводов, теплообменников, оборудования.
Итак, для вычисления индекса Ланжелье по уравнению (10) надо знать pHизмер — величину, измеряемую с помощью рН-метра (см. раздел 2). Сложнее дело обстоит с вычислением pHрасч по данным химического анализа. Расчет ведется по уравнению:
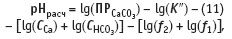
где ПРСаСО3 — произведение раствори мости карбоната кальция; lgK″— отрицательный логарифм константы диссоциации угольной кислоты на второй ступени диссоциации, т.е. с образованием иона СO3 2–; CСа, CНСО3 — концентрации иона кальция и гидрокарбонатиона, соответственно, определяемые химическим анализом;
lgf2+ lgf1— сумма коэффициентов активности двухзарядных и однозарядных ионов.
Все входящие в уравнение (11) величины, в свою очередь, можно рассчитать по уравнениям, которые получены автором аппроксимацией соответствующих экспериментальных данных.
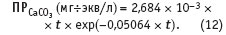
Это уравнение дает значение произведения растворимости карбоната кальция в воде в диапазоне температур от 20 до 200 °C со среднеквадратичным отклонением ±9,6 10–4 мг-экв/л2.
Аппроксимация литературных данных [3] о зависимости отрицательного логарифма константы 2-й ступени диссоциации угольной кислоты от температуры приводит к следующему уравнению, справедливомув диапазоне температур от 0 до 80 °С:
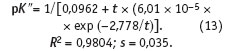
Константу 2-й ступени диссоциации угольной кислоты вычислим по уравнению (14):
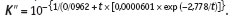
Для примера, при температуре 25 °С K″= 5,6 1011, как это указано в справочнике. Расчет коэффициентов активности требует специальных пояснений. Как следует из уравнения (9), коэффициент активности f отражает степень отклонения активности иона (вещества) от его концентрации, определяемой химическим анализом. Численные значения коэффициента активности заключены между 0 и 1.
Чем более ион связан молекулами растворителя (структурирует раствор), тем ниже значение коэффициента активности. Как следствие, коэффициент активности зависит от заряда Zi и концентрации ионов Ci, находящихся в растворе, т.е. от ионной силы J раствора.
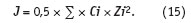
Аппроксимация экспериментальных данных [3] устанавливает следующую связь коэффициента активности c ионной силой:
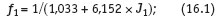
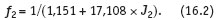
В конечном итоге, после вычисления всех слагаемых уравнения (11), их суммирования и подстановки результата в уравнение (10), определяется индекс Ланжелье (ИЛ). Знак и величина ИЛ характеризуют коррозионно-накипные свойства воды.
(Завершение статьи — в следующем номере)
Литература1. Присяжнюк В.А. // «С.О.К.». — 2004. — №4. — C. 14–29.2. Присяжнюк В.А. // «С.О.К.». — 2004. — №10. — C. 24–36.3. Громогласов А.А., Копылов А.Ф., Пильщиков А.П. Водоподготовка: процессы и аппараты. — М.: Энергоатомиздат, 1990.









